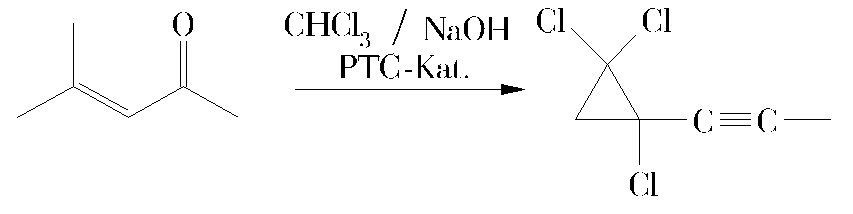
Wie oft in der Forschung liegt der Keim der Diplomarbeit in einer ganz anderen Untersuchung:
Es galt, den Mechanismus der Additionsreaktion von Dichlorcarben an Mesityloxid aufzuklären. Bei der Umsetzung von Mesityloxid mit Dichlorcarben unter phasentransfer-katalytischen Bedingungen entsteht nämlich ein nicht-triviales Addukt:
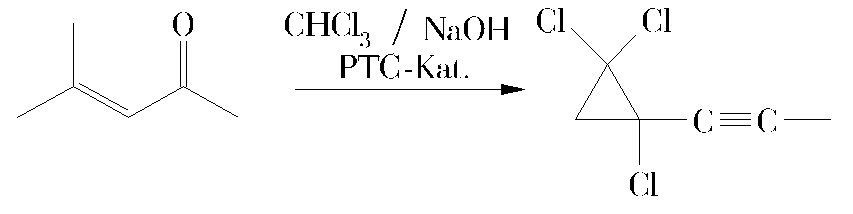
Bislang wurden vier Mechanismus-Vorschläge aufgeworfen, von denen durch die Synthese von Zwischenverbindungen und deren Einsatz in die Reaktiosbedingungen drei widerlegt werden konnten:

Unter den Bedingungen der Phasentransfer-Katalyse sollen zwei Carbene an den Doppelbindungen angreifen und erst zu einem Verlust von Phosgen, dann zu einer Ringöffnung unter Eliminierung eines Chloratoms führen. Das sich bildende Heptenin soll durch Addition eines Carbens zum gewünschten Produkt abreagieren.
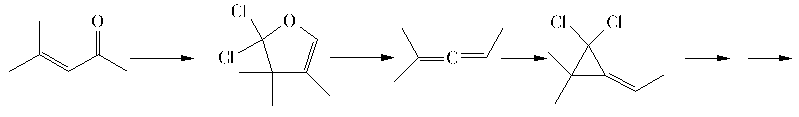
Durch einen Angriff des Dihalogencarbens an der Carbonylgruppe bildet sich ein Dihydrofuranring, der unter Phosgen-Abspaltung zu einem Keten weiterreagiert. An dieses kann ein weiteres Carben angreifen, das durch eliminierende Ringöffnung zu einer Kettenverlängerung führt. Eine anschließende Dehydrohalogenierung führt zu dem Heptenin, das zum Produkt weiterreagieren können soll.
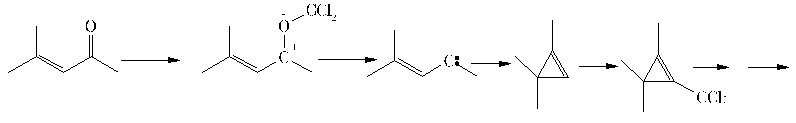
Durch eine Anlagerung eines Dichlorcarbens an den Carbonylsauerstoff und Abspaltung von Phosgen bildet sich ein ungesättigtes Carben, das intramolekular reagiert und zu einer Cyclisierung führt. Das sich bildende Cyclopropen lagert ein zweites Carben an. Durch sich anschließende Ringöffnungs- und Isomerisierungsschritte soll sich wieder ein Heptenin bilden, das wiederum zum Produkt abreagieren kann.
Aus diesen Reaktionsmechanismen wurden in der Vergangenheit diverse Zwischenverbindungen synthetisiert und unter den ursprünglichen Reaktionsbedingungen eingesetzt. Keine der Zwischenverbindungen führte zum Reaktionsprodukt von Mesityloxid mit Dihalogencarben.
Ein vierter Mechanismus stellt die Hypothese auf, daß ein Angriff eines Dihalogencarbens an der Carbonyl-Doppelbindung unter Bildung eines Oxirans stattfindet, das sich unter Ringöffnung und Halogenidwanderung zu einem Säurechlorid (und unter den gegebenen alkalischen Bedingungen zur Carbonsäure) umlagert. Diese kann Decarboxylieren und Dehydrohalogenieren, wobei sich wieder das Heptenin bildet:
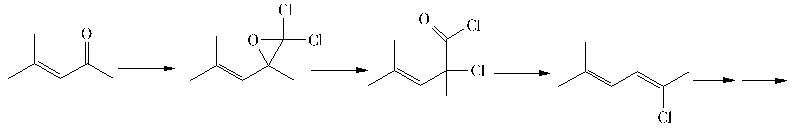
Als Modellsubstanz für das zweite Intermediat wurden ungesättigte Carbonsäuren und Carbonsäureester auf ihre Reaktivität gegenüber Dihalogencarbenen untersucht.
Zu meiner Mainpage
Meine Dissertation
Mein Lebenslauf
Zur OCIII-Homepage